برای دانلود یا چاپ این صفحه به زبانی دیگر، ابتدا زبان خود را از منوی کشویی در بالا سمت چپ انتخاب کنید.

مقاله موقعیت IAOMT در مورد کاویتاسیون استخوان فک انسان
رئیس کمیته آسیب شناسی استخوان فک: تد ریس، DDS، MAGD، NMD، FIAOMT
کارل اندرسون، DDS، MS، NMD، FIAOMT
پاتریشیا بروبه، DMD، MS، CFMD، FIAOMT
جری بوکو ، DDS ، MSD
ترزا فرانکلین، دکترا
جک کال، DMD، FAGD، MIAOMT
کودی کریگل، DDS، NMD، FIAOMT
Sushma Lavu، DDS، FIAOMT
تیفانی شیلدز، DMD، NMD، FIAOMT
مارک ویسنیفسکی، DDS، FIAOMT
کمیته مایل است قدردانی خود را از Michael Gossweiler، DDS، MS، NMD، Miguel Stanley، DDS و Stuart Nunally، DDS، MS، FIAOMT، NMD برای انتقادهایشان از این مقاله ابراز کند. ما همچنین مایلیم از مشارکت و تلاش ارزشمند دکتر نونالی در تدوین مقاله موضع 2014 تقدیر کنیم. کار، پشتکار و تمرین او ستون فقرات این مقاله به روز شده را فراهم کرد.
تایید شده توسط هیئت مدیره IAOMT سپتامبر 2023
فهرست مطالب
توموگرافی کامپیوتری با پرتو مخروطی (CBCT)
ملاحظات در حال تحول برای اهداف تشخیصی
منابع
پیوست اول نتایج نظرسنجی IAOMT 2
ضمیمه دوم نتایج نظرسنجی IAOMT 1
ضمیمه III تصاویر
شکل 1 استئونکروز دژنراتیو چربی استخوان فک (FDOJ)
شکل 2 سیتوکین ها در FDOJ در مقایسه با کنترل سالم
شکل 3 روش جراحی برای FDOJ رترومولار
شکل 4 کورتاژ و اشعه ایکس مربوط به FDOJ
فیلم کلیپ های ویدئویی جراحی استخوان فک در بیماران
در طول دهه گذشته آگاهی فزاینده ای در بین عموم مردم و ارائه دهندگان مراقبت های بهداشتی در مورد ارتباط بین سلامت دهان و دندان و سیستمیک وجود داشته است. به عنوان مثال، بیماری پریودنتال یک عامل خطر برای دیابت و بیماری قلبی است. همچنین یک ارتباط بالقوه پیامد و تحقیقاتی فزاینده بین آسیب شناسی استخوان فک و سلامت و سرزندگی کلی فرد نشان داده شده است. استفاده از روشهای تصویربرداری پیشرفته مانند توموگرافی کامپیوتری با پرتو مخروطی (CBCT) در شناسایی پاتولوژیهای استخوان فک، که منجر به بهبود قابلیتهای تشخیصی و بهبود توانایی برای ارزیابی موفقیت مداخلات جراحی شده است، مفید بوده است. گزارشهای علمی، فیلمهای مستند و رسانههای اجتماعی آگاهی عمومی را از این آسیبشناسی افزایش دادهاند، بهویژه در میان افرادی که از شرایط عصبی مزمن یا سیستمیک غیرقابل توضیحی رنج میبرند که به مداخلات پزشکی یا دندانپزشکی سنتی پاسخ نمیدهند.
آکادمی بین المللی پزشکی دهان و سم شناسی (IAOMT) بر این باور است که علم باید مبنایی باشد که بر اساس آن تمام روش های تشخیصی و درمانی انتخاب و استفاده شود. با در نظر گرفتن این اولویت است که ما 1) این به روز رسانی را به مقاله وضعیت پوکی استخوان فک IAOMT 2014 ارائه می کنیم، و 2) بر اساس مشاهدات بافت شناسی، نام علمی و پزشکی دقیق تری برای این بیماری، به ویژه بیماری مزمن ایسکمیک مدولاری، پیشنهاد می کنیم. استخوان فک (CIMDJ). CIMDJ یک وضعیت استخوانی را توصیف می کند که با مرگ اجزای سلولی استخوان اسفنجی، ثانویه به وقفه در جریان خون مشخص می شود. در طول تاریخچه آن، چیزی که ما از آن به عنوان CIMDJ یاد می کنیم، با نام ها و نام های اختصاری متعددی که در جدول 1 فهرست شده اند، ذکر شده است و در زیر به اختصار مورد بحث قرار خواهد گرفت.
هدف و هدف این آکادمی و مقاله ارائه علم، تحقیق و مشاهدات بالینی برای بیماران و پزشکان برای تصمیم گیری آگاهانه در هنگام بررسی این ضایعات CIMDJ است که اغلب به عنوان حفره استخوان فک از آن یاد می شود. این مقاله در سال 2023 با تلاش مشترکی که شامل پزشکان، محققان و یک آسیب شناس برجسته استخوان فک، دکتر جری بوکوت، پس از بررسی بیش از 270 مقاله بود، تهیه شد.
در هیچ استخوان دیگری به اندازه استخوان های فک احتمال آسیب و عفونت وجود ندارد. مروری بر ادبیات مربوط به موضوع حفرههای استخوان فک (یعنی CIMDJ) نشان میدهد که این بیماری از دهه 1860 تشخیص، درمان و تحقیق شده است. در سال 1867، دکتر اچ آر نوئل ارائه ای با عنوان ارائه کرد سخنرانی در مورد پوسیدگی و نکروز استخوان در کالج جراحی دندان بالتیمور، و در سال 1901 حفره های استخوان فک توسط ویلیام سی. بارت در کتاب درسی خود با عنوان، آسیب شناسی دهان و عمل: کتاب درسی برای استفاده از دانشجویان در دانشکده های دندانپزشکی و کتابچه راهنمای دندانپزشکان مورد بحث قرار گرفت. جی وی بلک، که اغلب به عنوان پدر دندانپزشکی مدرن شناخته می شود، بخشی را در کتاب درسی خود در سال 1915، تحت عنوان آسیب شناسی دندان ویژه، برای توصیف «ظاهر معمول و درمان» چیزی که او به عنوان استئونکروز استخوان فک (JON) توصیف کرد، گنجاند.
به نظر میرسید که تحقیقات در مورد حفرههای استخوان فک تا دهه 1970 متوقف شد، زمانی که دیگران شروع به تحقیق در مورد این موضوع کردند، با استفاده از نامها و برچسبهای مختلف و انتشار اطلاعات مربوط به آن در کتابهای درسی آسیبشناسی دهان مدرن. به عنوان مثال، در سال 1992، Bouquot و همکاران، التهاب داخل استخوانی را در بیماران مبتلا به دردهای مزمن و شدید صورت مشاهده کردند (N = 135) و اصطلاح "استئونکروز حفره ای ناشی از نورالژی" یا NICO را ابداع کردند. اگرچه Bouquot و همکارانش در مورد علت بیماری اظهار نظر نکردند، اما آنها به این نتیجه رسیدند که احتمال دارد ضایعات باعث ایجاد نورالژی مزمن صورت با ویژگی های موضعی منحصر به فرد شوند: تشکیل حفره داخل استخوانی و نکروز استخوانی طولانی مدت با حداقل بهبودی. راتنر و همکاران در یک مطالعه بالینی روی بیماران مبتلا به نورالژی سه قلو (N=38) و صورت (N=33) نشان دادند که تقریباً همه بیماران دارای حفره در استخوان آلوئول و استخوان فک بودند. حفره هایی که گاهی بیش از 1 سانتی متر قطر دارند، در محل کشیدن دندان های قبلی قرار داشتند و عموماً با اشعه ایکس قابل تشخیص نبودند.

 انواع دیگر اصطلاحات برای آنچه ما به عنوان CIMDJ شناسایی می کنیم در ادبیات وجود دارد. این موارد در جدول 1 فهرست شده و در اینجا به اختصار مورد بحث قرار گرفته است. آدامز و همکاران اصطلاح استئومیلیت فیبروزان مزمن (CFO) را در یک مقاله موضعی در سال 2014 ابداع کردند. این مقاله نتیجه یک کنسرسیوم چند رشتهای از پزشکان در زمینههای پزشکی دهان، ریشههای ریشه، آسیبشناسی دهان، نورولوژی، روماتولوژی، گوش و حلق و بینی، پریودنتولوژی، روانپزشکی، رادیولوژی دهان و فک و صورت، بیهوشی، دندانپزشکی عمومی، و مدیریت داخلی است. . تمرکز این گروه ارائه یک بستر بین رشته ای برای درمان بیماری های مرتبط با سر، گردن و صورت بود. از طریق تلاش های جمعی این گروه، جستجوهای گسترده ادبیات و مصاحبه با بیماران، یک الگوی بالینی متمایز پدیدار شد که آنها از آن به عنوان CFO یاد کردند. آنها خاطرنشان کردند که این بیماری اغلب به دلیل بیماری های همراه با سایر شرایط سیستمیک تشخیص داده نمی شود. این گروه به ارتباط بالقوه بین بیماری و مسائل سلامت سیستمیک و نیاز به تیمی از پزشکان برای تشخیص و درمان صحیح بیمار اشاره کردند.
انواع دیگر اصطلاحات برای آنچه ما به عنوان CIMDJ شناسایی می کنیم در ادبیات وجود دارد. این موارد در جدول 1 فهرست شده و در اینجا به اختصار مورد بحث قرار گرفته است. آدامز و همکاران اصطلاح استئومیلیت فیبروزان مزمن (CFO) را در یک مقاله موضعی در سال 2014 ابداع کردند. این مقاله نتیجه یک کنسرسیوم چند رشتهای از پزشکان در زمینههای پزشکی دهان، ریشههای ریشه، آسیبشناسی دهان، نورولوژی، روماتولوژی، گوش و حلق و بینی، پریودنتولوژی، روانپزشکی، رادیولوژی دهان و فک و صورت، بیهوشی، دندانپزشکی عمومی، و مدیریت داخلی است. . تمرکز این گروه ارائه یک بستر بین رشته ای برای درمان بیماری های مرتبط با سر، گردن و صورت بود. از طریق تلاش های جمعی این گروه، جستجوهای گسترده ادبیات و مصاحبه با بیماران، یک الگوی بالینی متمایز پدیدار شد که آنها از آن به عنوان CFO یاد کردند. آنها خاطرنشان کردند که این بیماری اغلب به دلیل بیماری های همراه با سایر شرایط سیستمیک تشخیص داده نمی شود. این گروه به ارتباط بالقوه بین بیماری و مسائل سلامت سیستمیک و نیاز به تیمی از پزشکان برای تشخیص و درمان صحیح بیمار اشاره کردند.
ضایعات حفره ای استخوان فک نیز در کودکان مشاهده شده است. در سال 2013، اوبل و همکاران ضایعات را در کودکان توصیف کردند و اصطلاح استئومیلیت مزمن فک پایین (JMCO) را ابداع کردند. این گروه استفاده احتمالی از بیس فسفونات های داخل وریدی (IV) را به عنوان درمان برای این کودکان پیشنهاد کردند. در سال 2016 Padwa و همکاران مطالعهای را منتشر کردند که در آن استئیت التهابی استریل کانونی در استخوانهای فک بیماران اطفال توضیح میداد. آنها ضایعه استئومیلیت مزمن غیر باکتریایی کودکان (CNO) را برچسب گذاری کردند.
از سال 2010، دکتر Johann Lechner، نویسنده و محققی که به طور گسترده در مورد ضایعات حفره ای استخوان فک منتشر شده است، و دیگران در حال تحقیق در مورد رابطه این ضایعات با تولید سیتوکین، به خصوص سیتوکین التهابی RANTES (همچنین به عنوان CCL5) هستند. دکتر لکنر از اصطلاحات مختلفی برای توصیف این ضایعات استفاده کرده است که شامل NICO قبلا ذکر شده و همچنین استئونکروز ایسکمیک آسپتیک در استخوان فک (AIOJ) و استئونکروز دژنراتیو چربی استخوان فک (FDOJ) می شود. توصیف/برچسب او بر اساس ظاهر فیزیکی و/یا وضعیت پاتولوژیک ماکروسکوپی است که به صورت بالینی یا حین عمل مشاهده می شود.
اکنون نیاز به روشن شدن یکی دیگر از پاتوزهای استخوان فک که اخیراً شناسایی شده است وجود دارد که از موضوع این مقاله متمایز است اما می تواند برای کسانی که در مورد ضایعات حفره ای تحقیق می کنند گیج کننده باشد. اینها ضایعات استخوانی فک هستند که در نتیجه استفاده از داروها ایجاد می شوند. ضایعات با از دست دادن خونرسانی و متعاقب آن جداسازی غیرقابل کنترل استخوان مشخص می شوند. این ضایعات توسط Ruggiero و همکاران در یک مقاله موضعی، زخم دهان با ترسیب استخوان (OUBS) نامیده شده است. انجمن جراحان دهان و فک و صورت آمریکا (AAOMS)، و همچنین توسط Palla و همکاران، در یک بررسی سیستماتیک. از آنجایی که این مشکل به استفاده از یک یا چند دارو مربوط می شود، IAOMT بر این عقیده است که این نوع ضایعه به بهترین شکل به عنوان استئونکروز فک مرتبط با دارو (MRONJ) توصیف می شود. MRONJ در این مقاله مورد بحث قرار نخواهد گرفت زیرا علت شناسی و رویکردهای درمانی آن با آنچه که ما به عنوان CIMDJ از آن یاد می کنیم متفاوت است و قبلاً به طور گسترده مورد مطالعه قرار گرفته است.
استفاده روزافزون از رادیوگرافی کامپیوتری با پرتو مخروطی (CBCT) توسط بسیاری از دندانپزشکان منجر به افزایش رعایت حفره های داخل مدولاری شده است که ما به عنوان CIMDJ از آنها یاد می کنیم و قبلا نادیده گرفته می شدند و از این رو نادیده گرفته می شدند. اکنون که این ضایعات و ناهنجاریها با سهولت بیشتری شناسایی شدهاند، تشخیص بیماری و ارائه توصیههای درمانی و مراقبتها بر عهده حرفه دندانپزشکی است.
قدردانی و شناسایی وجود CIMDJ نقطه شروع درک آن است. صرف نظر از نامها و نامهای اختصاری زیادی که با آسیب شناسی مرتبط است، وجود استخوان نکروزه یا در حال مرگ در بخش مدولاری استخوان فک به خوبی ثابت شده است.
هنگامی که در طی جراحی مشاهده می شود این نقایص استخوانی خود را به طرق متعدد نشان می دهند. برخی از پزشکان گزارش میدهند که بیش از 75 درصد ضایعات کاملاً توخالی هستند یا با بافت نرم، قهوهای مایل به خاکستری و غیر معدنی/گرانولوماتیس پر شدهاند، که اغلب با مواد روغنی زرد رنگ (کیستهای روغنی) در نواحی معیوب با آناتومی استخوان طبیعی اطراف یافت میشود. برخی دیگر وجود حفرههایی با تراکم استخوان قشر مغزی متفاوت را گزارش میکنند که پس از باز کردن، به نظر میرسد که دارای پوششهایی با مواد رشتهای فیبری سیاه، قهوهای یا خاکستری هستند. برخی دیگر گزارش میکنند که تغییرات ناخالصی را بهعنوان «ریسهدار»، «شبیه خاک اره»، «حفرههای توخالی» و «خشک» با گاه به گاه اسکلروتیک و سختی دندان مانند دیوارههای حفره توصیف میکنند. در معاینه بافت شناسی، این ضایعات شبیه به نکروزی است که در سایر استخوان های بدن رخ می دهد و از نظر بافت شناسی با استئومیلیت متفاوت است (شکل 1 را ببینید). تصاویر اضافی نشاندهنده بیماری CIMDJ، برخی از آنها که ماهیت گرافیکی دارند، در ضمیمه III در انتهای این سند آمده است.
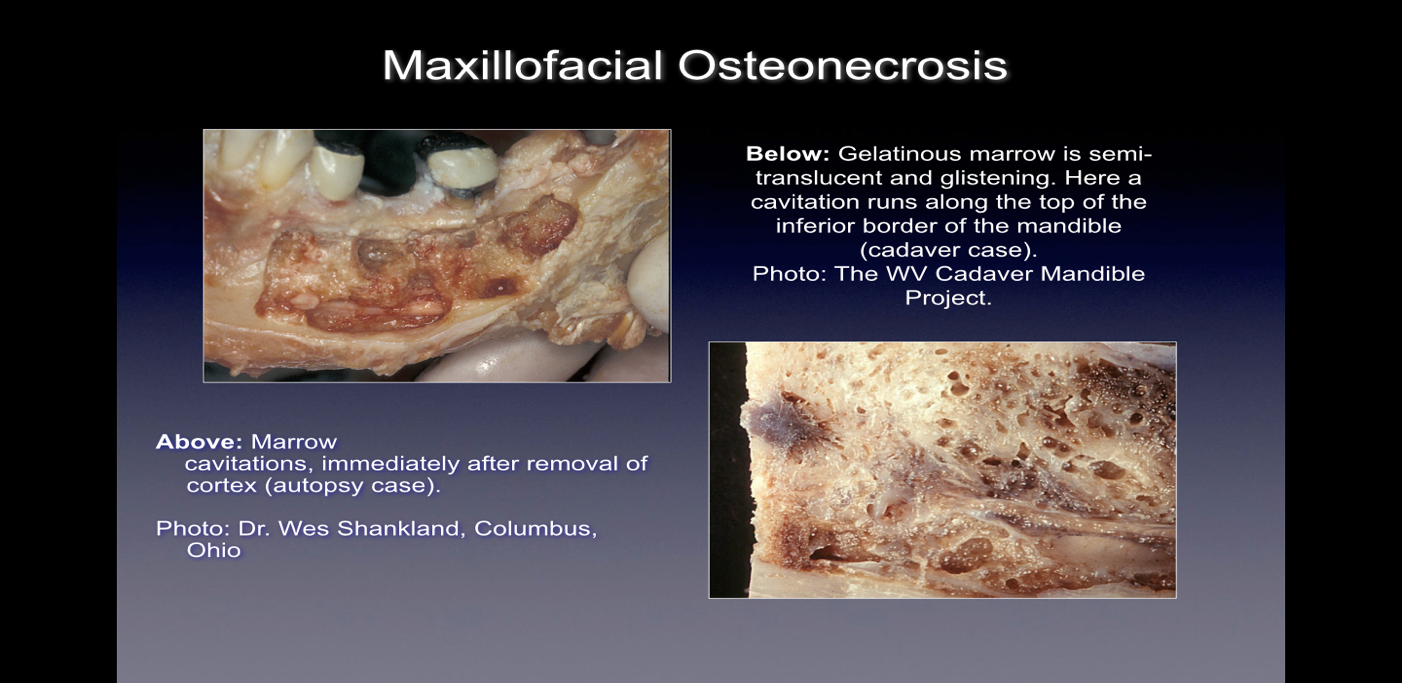
شکل 1 تصاویر CIMDJ از یک جسد گرفته شده است
مانند سایر پزشکان، دندانپزشکان از یک فرآیند سازمان یافته استفاده می کنند که از روش ها و روش های مختلف برای تشخیص ضایعات حفره ای استفاده می کند. اینها ممکن است شامل انجام یک معاینه فیزیکی باشد که شامل گرفتن سابقه سلامتی، ارزیابی علائم، دریافت مایعات بدن برای انجام آزمایشهای آزمایشگاهی، و گرفتن نمونههای بافتی برای بیوپسی و آزمایش میکروبیولوژیکی (یعنی آزمایش وجود پاتوژنها) است. فناوری های تصویربرداری مانند CBCT نیز اغلب استفاده می شود. در بیماران مبتلا به اختلالات پیچیده که همیشه از یک الگو پیروی نمی کنند یا با یک ترتیب معمولی از یک مجموعه علائم مطابقت ندارند، فرآیند تشخیصی می تواند به تجزیه و تحلیل دقیق تری نیاز داشته باشد که در ابتدا ممکن است فقط به تشخیص افتراقی منجر شود. شرح مختصری از چندین مورد از این روش های تشخیصی در زیر ارائه شده است.
توموگرافی کامپیوتری با پرتو مخروطی (CBCT)
تکنیک های تشخیصی که در اوایل سال 1979 توسط راتنر و همکارانش توصیف شد، با استفاده از لمس دیجیتال و فشار، تزریق بی حسی موضعی تشخیصی، در نظر گرفتن تاریخچه پزشکی و محل درد تشعشع در تشخیص حفره های استخوان فک مفید است. با این حال، در حالی که برخی از این ضایعات باعث درد، تورم، قرمزی و حتی تب می شوند، برخی دیگر چنین نیستند. بنابراین، اندازه گیری عینی تر، مانند تصویربرداری اغلب ضروری است.
حفرهها معمولاً در فیلمهای رادیوگرافی استاندارد دو بعدی (دو بعدی مانند پری آپیکال و پانورامیک) که معمولاً در دندانپزشکی استفاده میشوند، تشخیص داده نمیشوند. راتنر و همکارانش نشان داده اند که 2 درصد یا بیشتر از استخوان برای نشان دادن تغییرات نیاز به تغییر دارد، و این توسط کارهای بعدی پشتیبانی شده است و در شکل 40 نشان داده شده است. ساختارهای تشریحی، پوشاندن مناطق مورد علاقه. در مورد نقص یا آسیب شناسی، به ویژه در فک پایین، اثر پوششی استخوان متراکم قشر مغز بر ساختارهای زیرین می تواند قابل توجه باشد. بنابراین، تکنیکهای تصویربرداری پیشرفته مانند CBCT، اسکن Tech 2، تصویربرداری رزونانس مغناطیسی (MRI) یا سونوگرافی فراصوت ترانس آلوئولار (CaviTAU™) مورد نیاز است.
از بین تکنیکهای مختلف تصویربرداری موجود، CBCT پرکاربردترین ابزار تشخیصی است که توسط دندانپزشکان درگیر در تشخیص یا درمان حفرهها استفاده میشود و بنابراین ابزاری است که به طور عمیق در مورد آن صحبت خواهیم کرد. سنگ بنای فناوری CBCT توانایی آن در مشاهده ضایعه مورد نظر در 3 بعد (فرونتال، ساژیتال، تاجی) است. ثابت شده است که CBCT یک روش مطمئن و دقیق برای شناسایی و تخمین اندازه و وسعت نقایص داخل استخوانی در فک با اعوجاج کمتر و بزرگنمایی کمتر نسبت به اشعه ایکس دو بعدی است.
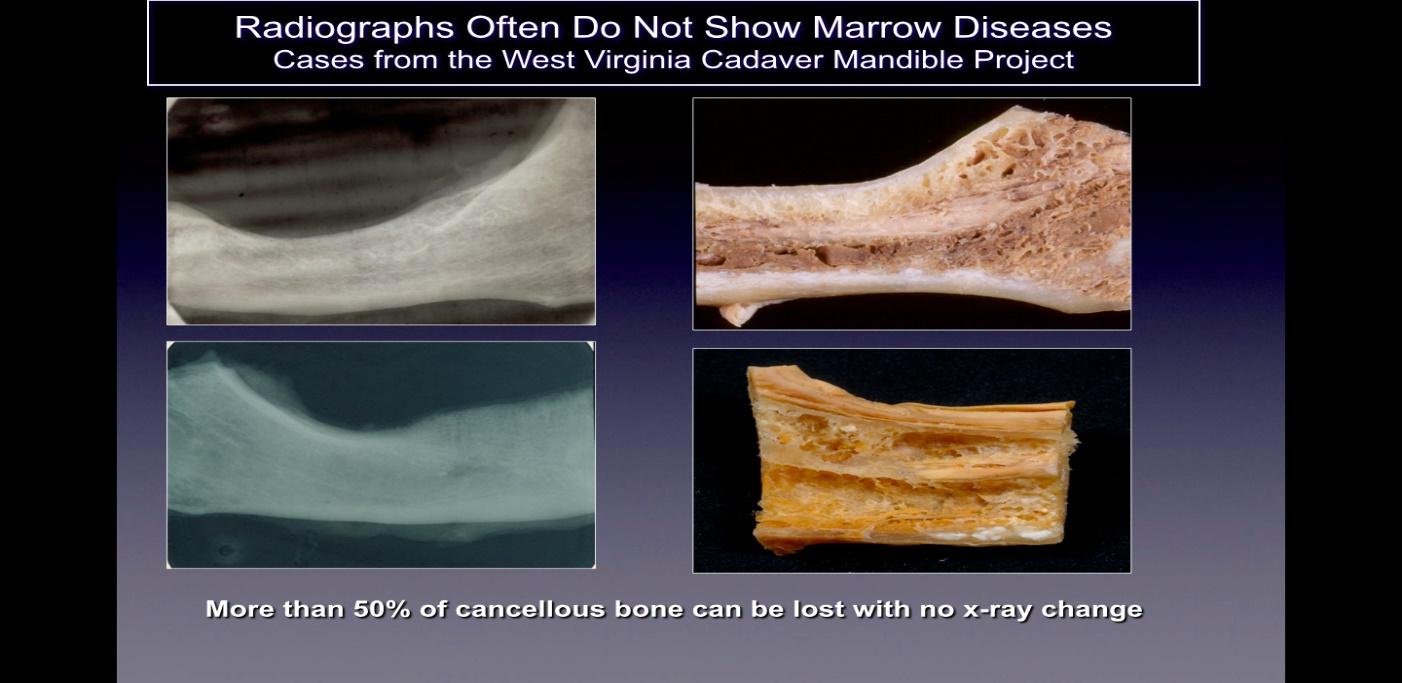
شکل 2 شرح: در سمت چپ رادیوگرافی دوبعدی از استخوان های فک گرفته شده از جسدهایی که ظاهر می شوند نشان داده شده است.
سالم. در سمت راست شکل، عکسهایی از همان استخوانهای فک وجود دارد که حفره نکروزه آشکار را نشان میدهد.
شکل اقتباس شده از Bouquot، 2014.
مطالعات بالینی نشان داده است که تصاویر CBCT به تعیین محتویات ضایعه (پر از مایع، گرانولوماتوز، جامد و غیره) نیز کمک می کند و احتمالاً به تشخیص ضایعات التهابی، تومورهای ادنتوژنیک یا غیر ادنتوژنیک، کیست ها و سایر خوش خیم یا بدخیم کمک می کند. ضایعات .
نرم افزاری که اخیراً توسعه یافته و به طور خاص با انواع مختلف دستگاه های CBCT ادغام شده است، از واحدهای هانسفیلد (HU) استفاده می کند که امکان ارزیابی استاندارد تراکم استخوان را فراهم می کند. HU نشان دهنده تراکم نسبی بافت های بدن بر اساس مقیاس درجه بندی شده در سطح خاکستری، بر اساس مقادیر هوا (1000- HU)، آب (0 HU) و تراکم استخوان (1000+ HU) است. شکل 3 نماهای مختلف یک تصویر CBCT مدرن را نشان می دهد.
به طور خلاصه، CBCT در تشخیص و درمان حفرههای استخوان فک مفید است:
- شناسایی اندازه، وسعت و موقعیت 3 بعدی ضایعه.
- شناسایی نزدیکی ضایعه به سایر ساختارهای آناتومیک حیاتی مجاور مانند
عصب آلوئولار تحتانی، سینوس ماگزیلاری یا ریشه دندان مجاور.
- تعیین رویکرد درمانی: جراحی در مقابل غیر جراحی. و
- ارائه تصویر بعدی برای تعیین درجه بهبودی و نیاز احتمالی
برای درمان مجدد ضایعه
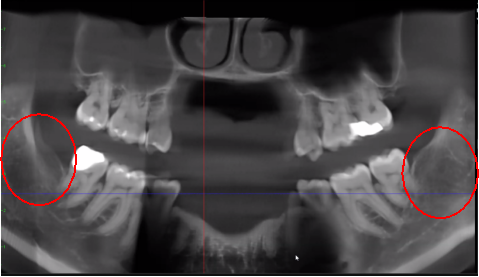
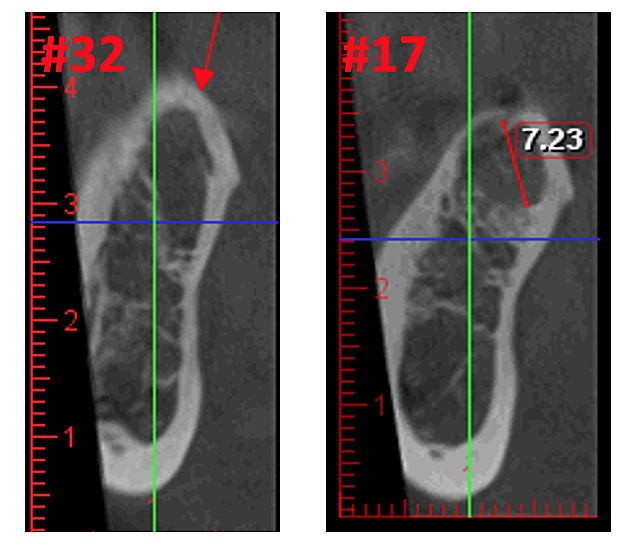
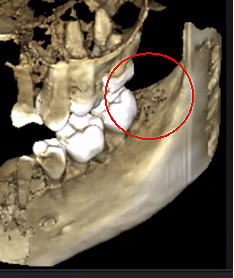
شکل 3 وضوح تصویر CBCT بهبود یافته به دلیل فناوری نرمافزاری پیشرفته، که مصنوعات و نویزهایی را که ایمپلنتهای دندانی و ترمیمهای فلزی میتوانند در تصویر ایجاد کنند، کاهش میدهد. این به دندانپزشک و بیمار اجازه می دهد تا ضایعه را راحت تر تجسم کنند. پانل بالایی یک نمای پانوراما از یک CBCT است که موقعیت و وسعت ضایعات حفره ای در سمت چپ (#17) و راست (#32) را در یک بیمار استئونکروز استخوان فک نشان می دهد. پانل پایین سمت چپ یک نمای ساژیتال از هر سایت است. پانل پایین سمت راست یک رندر سه بعدی از سایت شماره 3 است که تخلخل قشر مغز را روی کاویتاسیون مدولاری نشان می دهد. با حسن نیت از دکتر ریس.
ما همچنین در اینجا به طور خلاصه به یک دستگاه اولتراسوند به نام CaviTAU™ اشاره می کنیم که توسعه یافته و در بخش هایی از اروپا مورد استفاده قرار می گیرد، به ویژه برای تشخیص نواحی با تراکم استخوان پایین در استخوان های فک بالا و پایین که حاکی از حفره های استخوان فک هستند. این دستگاه سونوگرافی فراصوت ترانس آلوئولار (TAU-n) به طور بالقوه در مقایسه با CBCT در تشخیص نقایص مغز استخوان فک برابر است و مزیت بیشتری در قرار دادن بیمار در معرض سطوح بسیار پایین تابش دارد. این دستگاه در حال حاضر در ایالات متحده در دسترس نیست، اما توسط سازمان غذا و داروی ایالات متحده در دست بررسی است و به خوبی می تواند ابزار تشخیصی اولیه مورد استفاده در آمریکای شمالی برای درمان CIMJD باشد.
به دلیل ماهیت التهابی حفرههای استخوان فک، Lechner و Baehr، 2017 رابطه احتمالی بین سایتوکینهای انتخابی و بیماری را بررسی کردند. یکی از سیتوکینهای مورد علاقه «با فعالسازی تنظیم میشود، سلول T طبیعی بیان و ترشح میشود» (RANTES). این سیتوکین و همچنین فاکتور رشد فیبروبلاست (FGF)-2 به مقدار بیشتری در ضایعات حفره ای و در بیماران مبتلا به CIMDJ بیان می شود. شکل 4 که توسط دکتر لکنر ارائه شده است، سطوح RANTES را در بیماران مبتلا به کاویتاسیون (نوار قرمز، سمت چپ) با سطوح در کنترل سالم (نوار آبی) مقایسه میکند و سطوحی را نشان میدهد که بیش از 25 برابر بیشتر در افراد مبتلا به این بیماری است. Lechner و همکاران از دو روش برای اندازه گیری سطوح سیتوکین استفاده می کنند. یکی اندازه گیری سطح سیتوکین ها به صورت سیستمیک از خون (آزمایشگاه راه حل های تشخیصی، ایالات متحده.). روش دوم این است که بیوپسی مستقیماً از محل بیمار در هنگام دسترسی به آن برای ارزیابی توسط پاتولوژیست دهان انجام شود. متأسفانه، در این زمان، نمونه برداری بافت موضعی نیاز به پردازش و حمل و نقل پیچیده ای دارد که هنوز در امکانات غیرتحقیقی به دست نیامده است، اما همبستگی های روشنگری ارائه کرده است.
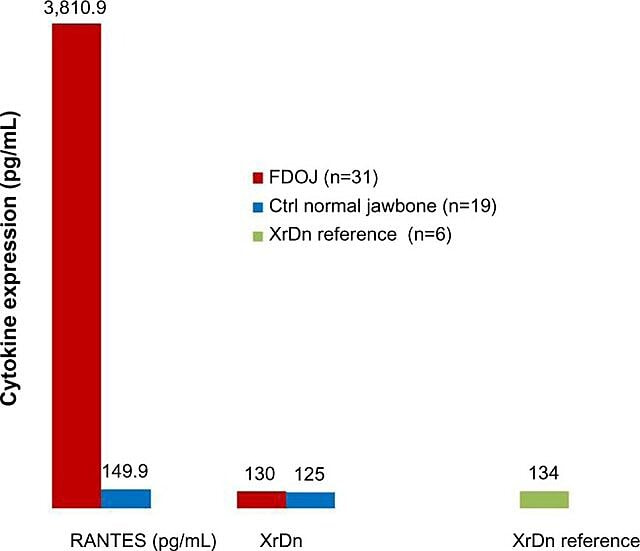
شکل 4 توزیع RANTES در 31 مورد FDOJ و 19 نمونه از استخوان فک طبیعی در مقایسه با مرجع تراکم اشعه ایکس برای هر دو گروه در مناطق مربوطه. اختصارات: RANTES، تنظیم پس از فعال شدن، سلول T طبیعی بیان و ترشح کموکاین (موتیف CC) لیگاند 5. XrDn، چگالی اشعه ایکس؛ FDOJ، استئونکروز دژنراتیو چربی استخوان فک. n، شماره؛ Ctrl، کنترل شکل ارائه شده توسط دکتر Lechner. شماره پروانه: CC BY-NC 3.0
ملاحظات در حال تحول برای اهداف تشخیصی
وجود حفره های استخوان فک از نظر بالینی به خوبی ثابت شده است. با این حال، تشخیص های واضح و پارامترهای درمان بهترین عمل نیاز به تحقیقات بیشتری دارد. با در نظر گرفتن این موضوع، لازم است به اختصار به چند تکنیک جذاب و بالقوه ارزشمند که توسط برخی از پزشکان استفاده می شود اشاره کنیم.
مشخص شده است که ارزیابی های فیزیولوژیک اضافی یک ابزار غربالگری و تشخیصی ارزشمند خواهد بود. یکی از ابزارهایی که توسط برخی از پزشکان استفاده می شود، تصویربرداری ترموگرافی است. فعالیت التهابی عمومی را می توان با اندازه گیری تفاوت های حرارتی در سطح سر و گردن مشاهده کرد. ترموگرافی ایمن، سریع است و ممکن است ارزش تشخیصی مشابه CBCT داشته باشد. یک اشکال مهم این است که تعریف ندارد و تشخیص حاشیه یا وسعت ضایعه را دشوار می کند.
برخی از پزشکان در حال بررسی مشخصات انرژی یک ضایعه با استفاده از ارزیابی مریدین طب سوزنی (AMA) برای تعیین تأثیر آن بر نصف النهار انرژی متناظر آن هستند. این نوع ارزیابی مبتنی بر طب سوزنی الکتریکی به گفته وول (EAV) است. این تکنیک که بر اساس اصول طب چینی و طب سوزنی باستانی است، در آمریکا توسعه یافته و در حال آموزش است. طب سوزنی برای کاهش درد و بهبودی استفاده می شود. این بر اساس تعادل جریان انرژی (یعنی چی) از طریق مسیرهای خاص انرژی در بدن است. این مسیرها یا مریدینها، اندامها، بافتها، ماهیچهها و استخوانهای خاصی را به یکدیگر متصل میکنند. طب سوزنی از نقاط بسیار خاصی روی یک نصف النهار استفاده می کند تا بر سلامت و شادابی تمام عناصر بدن در آن نصف النهار تأثیر بگذارد. این تکنیک برای آشکار کردن بیماری استخوان فک استفاده شده است، که وقتی برطرف شد، بیماریهای به ظاهر نامرتبط مانند آرتریت یا سندرم خستگی مزمن را نیز درمان میکند. این تکنیک خود را به بررسی بیشتر میرساند (یعنی نتایج باید مستند شده و دادههای طولی کسب و منتشر شوند).
عوامل فردی زیادی وجود دارد که خطر ایجاد حفره استخوان فک را افزایش می دهد، اما معمولاً این خطر چند عاملی است. خطرات برای فرد می تواند تأثیرات خارجی مانند عوامل محیطی یا تأثیرات داخلی مانند عملکرد ضعیف سیستم ایمنی باشد. جداول 2 و 3 عوامل خطر خارجی و داخلی را فهرست می کنند.


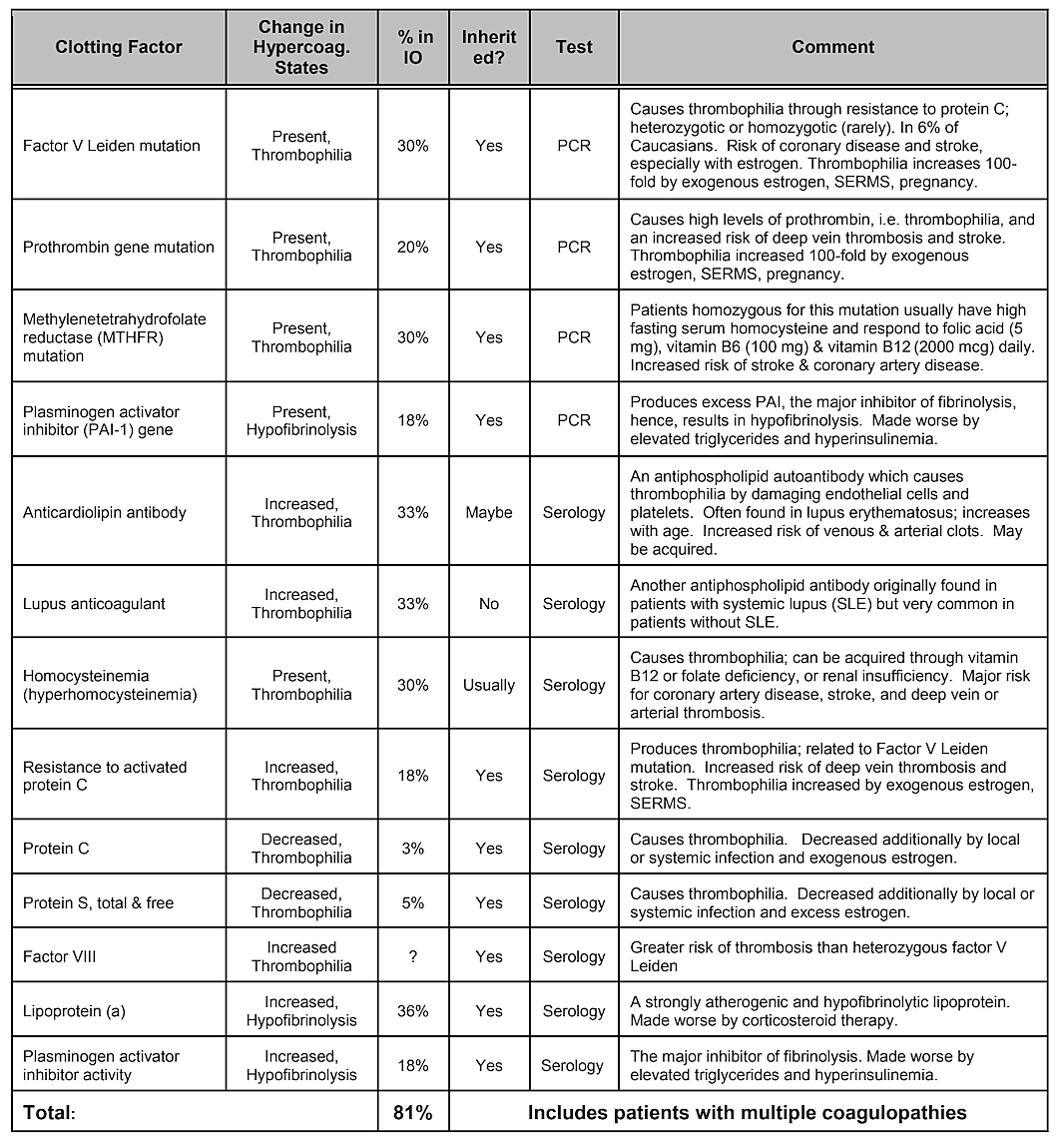
توجه داشته باشید که جدول 2، عوامل خطر داخلی، استعداد ژنتیکی را شامل نمی شود. در حالی که تصور می شود واریانس های ژنتیکی نقش دارند، هیچ گونه تنوع ژنی یا حتی ترکیبی از ژن ها به عنوان یک عامل خطر شناخته نشده است، با این حال تأثیرات ژنتیکی محتمل است. . یک مرور ادبیات سیستماتیک انجام شده در سال 2019 نشان داد که تعدادی از پلیمورفیسمهای تک نوکلئوتیدی شناسایی شدهاند، اما هیچ تکراری در بین مطالعات وجود ندارد. نویسندگان به این نتیجه رسیدند که با توجه به تنوع ژنهایی که ارتباط مثبتی با حفرهها نشان دادهاند و عدم تکرارپذیری مطالعات، نقشی که علل ژنتیکی بازی میکنند متوسط و ناهمگن به نظر میرسد. با این حال، هدف قرار دادن جمعیت های خاص ممکن است برای شناسایی تفاوت های ژنتیکی ضروری باشد. در واقع، همانطور که نشان داده شد، یکی از رایج ترین و اساسی ترین مکانیسم های پاتوفیزیولوژیک آسیب ایسکمیک استخوان، لخته شدن بیش از حد ناشی از حالت هایپرانعقاد است که معمولاً دارای زیربنای ژنتیکی هستند، همانطور که بوکوو و لامارچ (1999) توصیف کردند. جدول 4 ارائه شده توسط دکتر Bouquot، وضعیت های بیماری را فهرست می کند که شامل انعقاد بیش از حد است و 3 پاراگراف بعدی مروری بر برخی از یافته های دکتر Bouquot ارائه می دهد که او در نقش خود به عنوان مدیر تحقیقات در مرکز آموزش و تحقیقات فک و صورت ارائه کرده است.
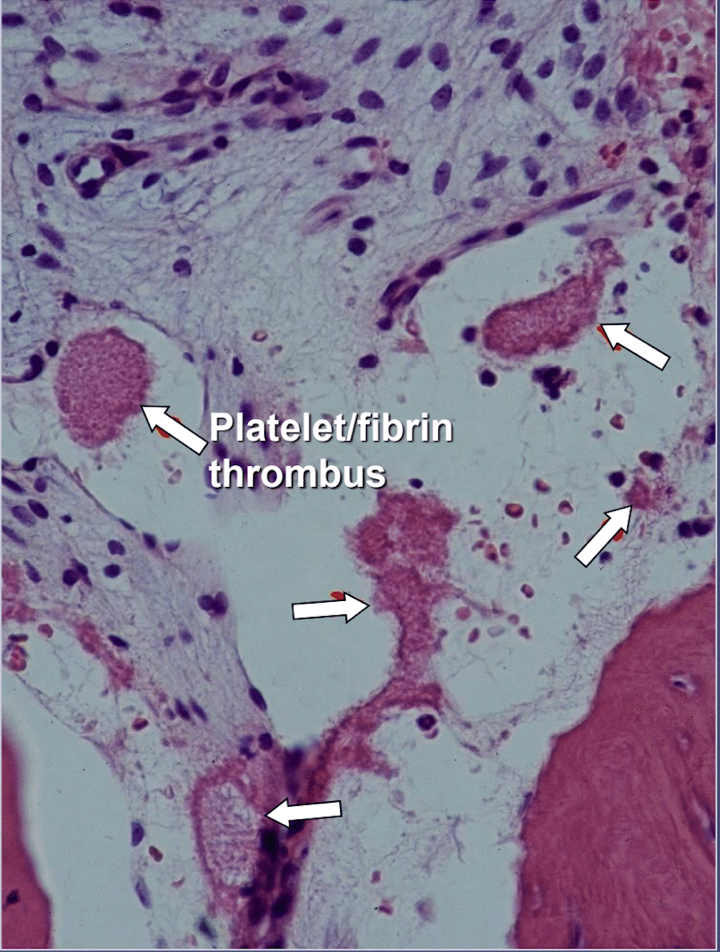
در حفره های استخوان فک شواهد واضحی از استئونکروز ایسکمیک وجود دارد که یک بیماری مغز استخوان است که در آن استخوان به دلیل کمبود اکسیژن و مواد مغذی نکروزه می شود. همانطور که گفته شد، عوامل زیادی می توانند برای ایجاد حفره با هم تعامل داشته باشند و تا 80 درصد از بیماران مشکل تولید بیش از حد لخته خون در رگ های خونی خود را دارند که معمولا ارثی است. این بیماری معمولاً در طی آزمایشات معمول خون آشکار نمی شود. استخوان به ویژه در برابر این مشکل انعقادی بیش از حد حساس است و رگهای خونی بسیار متسع میشود. افزایش فشارهای داخلی اغلب دردناک؛ رکود خون؛ و حتی انفارکتوس این مشکل انعقادی ممکن است با سابقه خانوادگی سکته مغزی و حملات قلبی در سنین پایین (کمتر از 55 سال)، تعویض مفصل ران یا "آرتریت" (به ویژه در سنین پایین)، استئونکروز (به ویژه در سنین پایین)، عمقی مطرح شود. ترومبوز ورید، آمبولی ریوی (لخته شدن خون در ریه)، ترومبوز سیاهرگ شبکیه (لخته شدن در شبکیه چشم) و سقط مکرر. فک ها 2 مشکل خاص با این بیماری دارند: 1) استخوان بیمار پس از آسیب، توانایی مقاومت ضعیفی در برابر عفونت های درجه پایین ناشی از باکتری های دندان و لثه ندارد. و 2) استخوان ممکن است از کاهش جریان خون ناشی از بی حس کننده های موضعی که توسط دندانپزشکان در حین کار دندانپزشکی استفاده می شود، بهبود نیابد. شکل 5 نمای میکروسکوپی از یک ترومب داخل عروقی را ارائه می دهد.
جدول 4 حالت های بیماری که شامل انعقاد بیش از حد است. از هر پنج بیمار کاویتاسیون استخوان فک، چهار نفر یکی از این لختهها را دارند
مشکلات عاملی
صرف نظر از علت زمینهای انعقاد زیاد، استخوان یا یک مغز فیبری (فیبرها میتوانند در مناطق محروم از مواد مغذی زندگی کنند)، یک مغز چرب چرب و مرده ("پوسیدگی مرطوب")، یک مغز بسیار خشک و گاهی چرمی ("پوسیدگی خشک") ایجاد میکند. ) یا یک فضای مغزی کاملا توخالی ("کاویتاسیون").
هر استخوانی ممکن است تحت تأثیر قرار گیرد، اما لگن، زانو و فک اغلب درگیر می شوند. درد اغلب شدید است اما حدود 1/3 استrd بیماران دردی را تجربه نمی کنند. بدن برای التیام خود از این بیماری مشکل دارد و 2/3rds در مواردی نیاز به برداشتن مغز آسیب دیده با جراحی، معمولاً با خراشیدن با کورت است. جراحی مشکل (و درد) را تقریباً در 3/4 از بین می برداینها از بیماران مبتلا به درگیری فک، اگرچه جراحی های مکرر، معمولاً روش های کوچکتر از اول، در 40٪ از بیماران، گاهی اوقات در سایر قسمت های فک مورد نیاز است، زیرا این بیماری اغلب دارای ضایعات "پرش" است (به عنوان مثال، چندین محل در فک استخوان های مشابه یا مشابه)، با مغز طبیعی بین. بیش از نیمی از بیماران هیپ در نهایت به این بیماری در لگن مقابل مبتلا می شوند. بیش از 1/3rd بیماران استخوان فک در سایر ربع های فک به این بیماری مبتلا می شوند. اخیراً مشخص شده است که 40 درصد از بیماران مبتلا به استئونکروز لگن یا فک به ضد انعقاد با هپارین با وزن مولکولی کم (Lovenox) یا کومادین با رفع درد و با بهبود استخوان پاسخ میدهند.
شکل 5 نمای میکروسکوپی از ترومبوس داخل عروقی
اگر به دنبال روشی غیردارویی برای کاهش خطر انعقاد خون هستید، میتوانید از آنزیمهای مکمل مانند ناتوکیناز یا لومبروکیناز قویتر استفاده کنید که هر دو دارای خواص فیبرینولیتیک و ضد انعقاد هستند. علاوه بر این، حالات کمبود مس، که با اختلال عملکرد انعقادی مرتبط است، باید رد شوند، زیرا خطر افزایش انعقاد در بیماران مبتلا به حفره استخوان فک مشاهده می شود.
وجود حفرههای استخوان فک و آسیبشناسی مرتبط با آنها شامل برخی علائم خاص است، اما اغلب شامل برخی علائم سیستمیک غیراختصاصی نیز میشود. بنابراین، تشخیص و درمان آن باید با بررسی کامل توسط تیم مراقبت انجام شود. منحصربهفردترین و پیشگامانهترین یافتههایی که از زمان مقاله موضع IAOMT 2014 آشکار شده است، حل شرایط التهابی مزمن به ظاهر نامرتبط پس از درمان کاویتاسیون است. چه بیماری های سیستمیک ماهیت خودایمنی داشته باشند یا التهابی که در غیر این صورت رخ می دهد، پیشرفت های قابل توجهی از جمله بهبود سرطان گزارش شده است. مجموعه علائم مرتبط با این ضایعات بسیار فردی است و بنابراین قابل تعمیم یا به راحتی قابل تشخیص نیست. بنابراین، IAOMT بر این عقیده است که زمانی که بیمار مبتلا به حفرههای استخوان فک با یا بدون درد موضعی مرتبط تشخیص داده میشود، و همچنین بیماری سیستمیک دیگری دارد که قبلاً به حفرههای استخوان فک نسبت داده نشده است، بیمار نیاز به ارزیابی بیشتر دارد تا مشخص شود آیا بیماری با آن مرتبط است یا خیر. ، یا پیامد بیماری است. IAOMT از اعضای خود نظرسنجی کرد تا درباره علائم/بیماری های سیستمیک پس از جراحی کاویتاسیون بیشتر بداند. نتایج در پیوست I ارائه شده است.
به نظر میرسد وجود سیتوکینهای تولید شده در ضایعات نکروزه و عروقی ضعیف حفرههای استخوان فک به عنوان کانونی از سایتوکاینهای التهابی عمل میکند که سایر نواحی التهاب را فعال و/یا مزمن نگه میدارد. تسکین یا حداقل بهبود درد موضعی فک پس از درمان، امید و انتظار می رود، اما این نظریه کانونی التهاب، که در زیر به تفصیل مورد بحث قرار خواهد گرفت، ممکن است توضیح دهد که چرا بسیاری از بیماری های به ظاهر «نامرتبط» که با شرایط التهابی مزمن ارتباط دارند. همچنین با درمان کاویتاسیون کاهش می یابد.
در حمایت از نتایج بدست آمده در مقاله موقعیت IAOMT در سال 2014 که حفره های استخوان فک و بیماری های سیستمیک را به هم مرتبط می کند، تحقیقات و مطالعات بالینی که اخیراً توسط Lechner، von Baehr و دیگران منتشر شده است، نشان می دهد که ضایعات حفره استخوان فک حاوی مشخصات سیتوکین خاصی است که در سایر آسیب شناسی های استخوانی دیده نمی شود. . در مقایسه با نمونههای استخوان فک سالم، آسیبشناسی حفرهای دائماً یک افزایش شدید فاکتور رشد فیبروبلاست (FGF-2)، آنتاگونیست گیرنده اینترلوکین 1 (Il-1ra) و از اهمیت ویژهای، RANTES را نشان میدهد. RANTES، همچنین به عنوان CCL5 (سی سی موتیف لیگاند 5) شناخته می شود، به عنوان یک سیتوکین کموتاکتیک با یک اثر پیش التهابی قوی توصیف شده است. نشان داده شده است که این کموکاین ها در چندین مرحله از پاسخ ایمنی تداخل دارند و به طور قابل توجهی در شرایط پاتولوژیک و عفونت های مختلف دخالت دارند. مطالعات نشان داده اند که RANTES در بسیاری از بیماری های سیستمیک مانند آرتریت، سندرم خستگی مزمن، درماتیت آتوپیک، نفریت، کولیت، آلوپسی، اختلالات تیروئید و ترویج مولتیپل اسکلروزیس و بیماری پارکینسون نقش دارد. علاوه بر این، نشان داده شده است که RANTES باعث تسریع رشد تومور می شود.
فاکتورهای رشد فیبروبلاست نیز در ایجاد کاویتاسیون استخوان فک نقش دارند. فاکتورهای رشد فیبروبلاست، FGF-2، و گیرنده های مرتبط با آنها، مسئول بسیاری از عملکردهای حیاتی از جمله تکثیر سلولی، بقا و مهاجرت هستند. آنها همچنین مستعد ربوده شدن توسط سلول های سرطانی و ایفای نقش انکوژنیک در بسیاری از سرطان ها هستند. به عنوان مثال، FGF-2 باعث پیشرفت تومور و سرطان در سرطان پروستات می شود. علاوه بر این، سطوح FGF-2 ارتباط مستقیمی با پیشرفت، متاستاز و پیش آگهی ضعیف بقا در بیماران مبتلا به سرطان کولورکتال نشان داده است. در مقایسه با گروه کنترل بدون سرطان، بیماران مبتلا به کارسینوم معده به طور قابل توجهی سطوح بالاتری از FGF-2 در سرم خود دارند. این پیام رسان های التهابی در بسیاری از بیماری های جدی دخیل هستند، چه ماهیت التهابی داشته باشند و چه سرطانی. برخلاف RANTES/CCL5 و FGF-2، نشان داده شده است که IL1-ra به عنوان یک واسطه ضد التهابی قوی عمل میکند و به فقدان علائم التهابی رایج در برخی از ضایعات حفره کمک میکند.
سطوح بیش از حد RANTES و FGF-2 در ضایعات حفره ای مقایسه شده و با سطوح مشاهده شده در سایر بیماری های سیستمیک مانند اسکلروز جانبی آمیوتروفیک، (ALS)، مولتیپل اسکلروزیس (MS)، آرتریت روماتوئید و سرطان سینه مرتبط است. در واقع، سطح این پیامرسانها در حفرههای استخوان فک بیشتر از سرم و مایع مغزی نخاعی بیماران ALS و MS است. تحقیقات فعلی توسط Lechner و von Baehr افزایش 26 برابری RANTES را در ضایعات استئونکروز استخوان فک در بیماران مبتلا به سرطان پستان نشان داده است. لکنر و همکارانش پیشنهاد می کنند RANTES حاصل از کاویتاسیون ممکن است به عنوان تسریع کننده توسعه و پیشرفت سرطان سینه عمل کند.
همانطور که قبلا ذکر شد، موارد متعددی از حفره بدون علامت استخوان فک وجود دارد. در این موارد، سیتوکینهای حاد پیش التهابی مانند TNF-alpha و IL-6 در یافتههای پاتوهیستولوژیک نمونههای کاویتاسیون به تعداد زیاد دیده نمیشوند. در این بیماران، فقدان این سیتوکین های پیش التهابی با سطوح بالای آنتاگونیست گیرنده اینترلوکین 1 سیتوکین ضد التهابی (Il-1ra) همراه است. نتیجه معقول این است که التهاب حاد مرتبط با حفره های استخوان فک تحت کنترل سطوح بالای RANTES/FGF-2 است. در نتیجه، برای تشخیص، Lechner و von Baehr پیشنهاد میکنند که تمرکز بر وجود التهاب را کاهش داده و مسیر سیگنالدهی را عمدتاً از طریق بیان بیش از حد RANTES/FGF-2 در نظر بگیرید. سطوح بالای RANTES/FGF-2 در بیماران کاویتاسیون نشان می دهد که این ضایعات ممکن است باعث ایجاد مسیرهای سیگنالینگ بیماری زا مشابه و متقابلاً تقویت کننده به سایر اندام ها شوند. سیستم ایمنی در پاسخ به سیگنالهای خطر فعال میشود، که مسیرهای مولکولی ذاتی مختلفی را برمیانگیزد که به تولید سیتوکینهای التهابی و فعال شدن احتمالی سیستم ایمنی تطبیقی ختم میشود. این موضوع از این ایده و نظریه حمایت می کند که حفره استخوان فک ممکن است به عنوان یک علت اساسی بیماری های التهابی مزمن از طریق تولید RANTES/FGF-2 عمل کند و بیشتر توضیح می دهد که چرا علائم حاد التهاب همیشه توسط بیمار در ضایعات استخوان فک دیده یا احساس نمی شود. خودشان بنابراین، حفرههای استخوان فک و این پیامرسانهای مرتبط، جنبهای یکپارچه از بیماری التهابی را نشان میدهند و به عنوان یک علت بالقوه بیماری عمل میکنند. حذف حفره ها ممکن است کلیدی برای معکوس کردن بیماری های التهابی باشد. این با مشاهده کاهش سطح سرمی RANTES پس از مداخله جراحی در 5 بیمار مبتلا به سرطان پستان پشتیبانی می شود (جدول 5 را ببینید). تحقیقات بیشتر و آزمایش سطوح RANTES/CCL5 ممکن است بینشی در مورد این رابطه ارائه دهد. مشاهدات دلگرم کننده، بهبود کیفیت زندگی است که توسط بسیاری از بیماران کاویتاسیون استخوان فک، خواه تسکین در محل عمل یا کاهش التهاب مزمن یا بیماری در جاهای دیگر باشد.
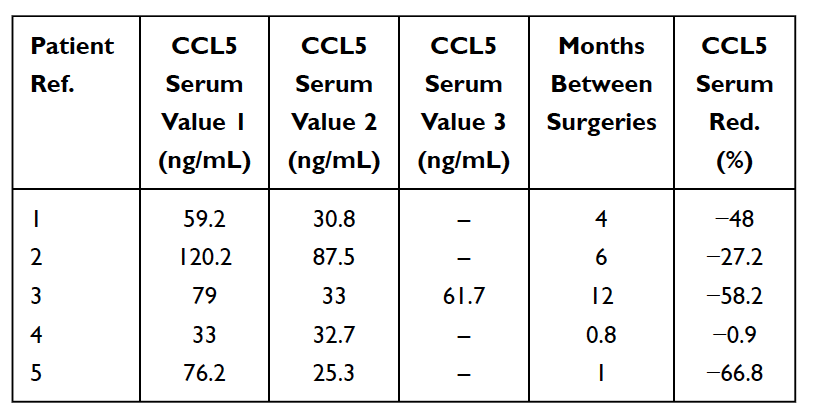
جدول 5
کاهش (قرمز) در RANTES/CCL5 سرم در 5 بیمار مبتلا به سرطان پستان که تحت عمل جراحی استئونکروز چربی-دژنراتیو استخوان فک (FDOJ) قرار گرفتند. جدول اقتباس شده از
Lechner et al, 2021. حفره استخوان فک بیان شده RANTES/CCL5: مطالعات موردی مرتبط با التهاب خاموش در استخوان فک با معرفت شناسی سرطان پستان. سرطان سینه: اهداف و درمان.
با توجه به کمبود ادبیات در مورد درمان ضایعات حفره ای، IAOMT اعضای خود را بررسی کرد تا اطلاعاتی را در مورد اینکه چه روندها و درمان هایی به سمت "استاندارد مراقبت" در حال توسعه هستند جمع آوری کند. نتایج نظرسنجی به طور خلاصه در ضمیمه دوم مورد بحث قرار گرفته است.
پس از تعیین محل و اندازه ضایعات، روش های درمانی مورد نیاز است. IAOMT بر این عقیده است که به طور کلی باقی گذاشتن "استخوان مرده" در بدن انسان غیرقابل قبول است. این بر اساس دادههایی است که نشان میدهد حفرههای استخوان فک میتوانند کانونی برای سیتوکینها و اندوتوکسینهای سیستمیک باشند تا روند تخریب سلامت کلی بیمار را آغاز کنند.
در شرایط ایده آل باید بیوپسی برای تایید تشخیص هر گونه آسیب شناسی استخوان فک و رد سایر بیماری ها انجام شود. سپس، درمان برای حذف یا حذف آسیب شناسی درگیر و تحریک رشد مجدد استخوان طبیعی و حیاتی ضروری است. در این زمان در ادبیات بررسی شده، به نظر می رسد درمان جراحی شامل بریدن استخوان غیر حیاتی آسیب دیده، درمان مطلوب برای حفره های استخوان فک باشد. درمان شامل استفاده از بیحس کنندههای موضعی است که به یک ملاحظات مهم منجر میشود. قبلاً تصور می شد که از داروهای بیهوش کننده حاوی اپی نفرین که دارای خواص انقباض عروقی شناخته شده هستند، باید در بیمارانی که ممکن است جریان خون مرتبط با وضعیت بیماری خود را مختل کرده باشند، اجتناب شود. با این حال، در یک سری از مطالعات مولکولی، تمایز استئوبلاستی با استفاده از اپی نفرین افزایش یافت. بنابراین، پزشک باید به صورت موردی تعیین کند که آیا از اپی نفرین استفاده کند یا خیر و اگر چنین است، مقداری که باید استفاده شود که بهترین نتیجه را به همراه خواهد داشت.
پس از عمل جراحی و کورتاژ کامل ضایعه و آبیاری با نرمال سالین استریل، با قرار دادن پیوندهای فیبرین غنی از پلاکت (PRF) در فضای خالی استخوانی، بهبودی بهبود می یابد. استفاده از کنسانتره های فیبرین غنی از پلاکت در روش های جراحی نه تنها از نقطه نظر لخته شدن مفید است، بلکه از جنبه آزادسازی فاکتورهای رشد در یک دوره حداکثر تا چهارده روز پس از عمل جراحی مفید است. قبل از استفاده از گرافت های PRF و سایر درمان های کمکی، عود ضایعه استئونکروز استخوان فک پس از جراحی در 40 درصد موارد رخ داده است.
مطالعه عوامل خطر خارجی بیان شده در جدول 2 قویاً نشان می دهد که می توان از پیامدهای نامطلوب با تکنیک جراحی مناسب و تعامل پزشک/بیمار، به ویژه در جمعیت های مستعد جلوگیری کرد. توصیه میشود که تکنیکهای اتروماتیک، به حداقل رساندن یا پیشگیری از بیماریهای پریودنتال و سایر بیماریهای دندانی، و انتخاب آرمنتاریومی که بهترین نتایج درمانی را ممکن میسازد، در نظر بگیرید. ارائه دستورالعمل های کامل قبل و بعد از عمل به بیمار، از جمله خطرات مرتبط با سیگار کشیدن، می تواند به به حداقل رساندن پیامدهای منفی کمک کند.
با در نظر گرفتن فهرست گسترده عوامل خطر بالقوه مندرج در جداول 2 و 3، مشاوره با تیم مراقبت گسترده بیمار توصیه می شود تا به درستی عوامل خطر پنهان احتمالی که ممکن است در ایجاد حفره استخوان فک کمک کنند، مشخص شود. به عنوان مثال، یک نکته مهم در درمان حفرههای استخوان فک این است که آیا فرد از داروهای ضد افسردگی، بهویژه مهارکنندههای انتخابی بازجذب سروتونین (SSRI) استفاده میکند یا خیر. SSRI ها با کاهش تراکم توده استخوانی و افزایش نرخ شکستگی مرتبط هستند. SSRI فلوکستین (پروزاک) به طور مستقیم تمایز و کانی سازی استئوبلاست ها را مهار می کند. حداقل دو مطالعه مستقل که کاربران SSRI را در مقایسه با گروه شاهد بررسی میکنند نشان دادهاند که استفاده از SRRI با شاخصهای مورفومتریک پانورامیک بدتری همراه است.
پیش شرطی کردن نیز ممکن است به نتایج موفقیت آمیز درمان کمک کند. این شامل ایجاد یک محیط بافتی مناسب برای بهبودی با تامین سطوح کافی از مواد مغذی مناسب برای بدن است که با بهینهسازی هموستاز در بدن، زمین بیولوژیکی را بهبود میبخشد. تاکتیکهای پیششرطی همیشه ممکن یا قابل قبول برای بیمار نیست، اما برای بیمارانی که دارای استعدادهای شناخته شده هستند، مانند افرادی که دارای استعداد ژنتیکی، اختلالات درمانی یا سلامتی به خطر افتاده هستند، مهمتر است. در چنین مواردی، بسیار مهم است که این بهینه سازی برای به حداقل رساندن سطوح استرس اکسیداتیو اتفاق بیفتد، که نه تنها می تواند روند بیماری را تحریک کند بلکه می تواند در بهبود مورد نظر نیز اختلال ایجاد کند.
در حالت ایده آل، کاهش هر گونه بار سمی روی بدن مانند فلوراید و/یا جیوه از پرکردگی های آمالگام دندان باید قبل از درمان پوسیدگی استخوان فک کامل شود. جیوه می تواند آهن را در زنجیره انتقال الکترون میتوکندری جابجا کند. این منجر به آهن آزاد اضافی (آهن آهنی یا Fe++) میشود که باعث تولید گونههای اکسیژن فعال آسیبرسان (ROS) که به عنوان رادیکالهای آزاد نیز شناخته میشوند، تولید میکنند که باعث استرس اکسیداتیو میشوند. آهن اضافی در بافت استخوانی نیز عملکرد مناسب استئوبلاست ها را مهار می کند، که بدیهی است در هنگام تلاش برای بهبود یک اختلال استخوانی تأثیر منفی خواهد داشت.
سایر کمبودها نیز باید قبل از درمان برطرف شوند. هنگامی که کمبود مس، منیزیم و رتینول در دسترس زیستی وجود داشته باشد، متابولیسم و بازیافت آهن در بدن دچار اختلال می شود، که به آهن آزاد اضافی در مکان های اشتباه منجر می شود که منجر به استرس اکسیداتیو حتی بیشتر و خطر بیماری می شود. به طور خاص، بسیاری از آنزیمها در بدن (مانند سرولوپلاسمین) زمانی غیرفعال میشوند که سطح مس، منیزیم و رتینول در دسترس زیستی کافی وجود نداشته باشد، که پس از آن اختلالات سیستمیک آهن و در نتیجه افزایش استرس اکسیداتیو و خطر ابتلا به بیماری را تداوم میبخشد.
تکنیک های جایگزین که به عنوان درمان های اولیه یا حمایتی استفاده می شوند نیز باید ارزیابی شوند. اینها شامل هومیوپاتی، تحریک الکتریکی، نور درمانی مانند تعدیل نوری، و لیزر، اکسیژن/ازون درجه پزشکی، اکسیژن هیپرباریک، روش های ضد انعقاد، داروهای سانوم، تغذیه و مواد غذایی، سونای مادون قرمز، اوزون درمانی داخل وریدی، انرژی درمانی و غیره است. در حال حاضر، علمی انجام نشده است که ثابت کند این اشکال جایگزین درمان قابل دوام یا ناکارآمد هستند. استانداردهای مراقبت برای اطمینان از بهبودی و سم زدایی مناسب باید ایجاد شود. تکنیک های ارزیابی موفقیت باید آزمایش و استاندارد شوند. پروتکل ها یا روش هایی برای کمک به تعیین اینکه چه زمانی درمان مناسب است و چه زمانی مناسب نیست، باید برای ارزیابی ارائه شوند.
تحقیقات نشان داده است که وجود کاویتاسیون استخوان فک یک فرآیند بیماری موذی است که با کاهش جریان خون همراه است. جریان خون مدولاری به خطر افتاده منجر به مینرالیزه شدن ضعیف و عروقی شدن ناکافی در نواحی از استخوان فک میشود که میتوانند با پاتوژنها آلوده شوند و مرگ سلولی را افزایش دهند. جریان خون کند در ضایعات حفره ای، تحویل آنتی بیوتیک ها، مواد مغذی و پیام رسان های ایمنی را به چالش می کشد. محیط ایسکمیک همچنین میتواند واسطههای التهابی مزمن را در خود جای دهد و آنها را تقویت کند که ممکن است اثرات مخربتری بر سلامت سیستمیک داشته باشند. استعداد ژنتیکی، کاهش عملکرد سیستم ایمنی، اثرات برخی داروها، تروما و عفونتها و عوامل دیگری مانند سیگار کشیدن میتوانند باعث تحریک یا تسریع ایجاد حفرههای استخوان فک شوند.
همراه با پاتولوژیست برجسته استخوان فک، دکتر جری بوکوت، IAOMT در حال ارائه و ترویج شناسایی صحیح بافت شناسی و پاتولوژیک ضایعات حفره ای استخوان فک به عنوان بیماری مزمن مدولاری ایسکمیک استخوان فک، CIMDJ است. اگرچه بسیاری از نامها، مخففها و اصطلاحات از لحاظ تاریخی برای نشان دادن این بیماری استفاده میشوند، IAOMT متقاعد شده است که این مناسبترین اصطلاح برای توصیف شرایط پاتولوژیک و میکروهیستولوژیک است که معمولاً در حفرههای استخوان فک یافت میشود.
اگرچه تشخیص اکثر ضایعات حفره ای استخوان فک با رادیوگرافی های معمول دشوار است و بیشتر آنها دردناک نیستند، هرگز نباید تصور کرد که روند بیماری وجود ندارد. بسیاری از فرآیندهای بیماری وجود دارند که تشخیص آنها دشوار است و بسیاری از آنها دردناک نیستند. اگر از درد به عنوان شاخصی برای درمان استفاده کنیم، بیماری پریودنتال، دیابت و بیشتر سرطان ها درمان نمی شوند. دندانپزشکان امروزی طیف وسیعی از روشها را برای درمان موفقیتآمیز حفرههای استخوان فک در اختیار دارند و عدم تشخیص بیماری و توصیه درمان کمتر از عدم تشخیص و درمان بیماری پریودنتال جدی نیست. برای سلامتی و رفاه بیماران ما، یک تغییر پارادایم برای همه متخصصان مراقبت های بهداشتی، از جمله دندانپزشکان و پزشکان، ضروری است تا 1) شیوع پوسیدگی استخوان فک را بشناسند و 2) ارتباط بین پوسیدگی استخوان فک و بیماری سیستمیک را تصدیق کنند.
نتایج نظرسنجی IAOMT 2 (2023)
همانطور که به طور خلاصه در مقاله بحث شد، شرایط نامرتبط اغلب پس از جراحی کاویتاسیون بهبود می یابند. برای کسب اطلاعات بیشتر در مورد اینکه چه نوع شرایطی برطرف می شوند و چگونه بهبودی پروگزیمال در رابطه با جراحی رخ می دهد، نظرسنجی دوم برای اعضای IAOMT ارسال شد. فهرستی از علائم و شرایطی که اعضای این کمیته برای بهبود پس از جراحی مشاهده کردهاند، برای نظرسنجی تهیه شد. از پاسخ دهندگان پرسیده شد که آیا هر یک از این شرایط را پس از عمل جراحی مشاهده کرده اند و اگر چنین است تا چه حد. همچنین از آنها پرسیده شد که آیا علائم به سرعت از بین رفتند یا اینکه بهبودها بیش از دو ماه طول کشید. علاوه بر این، از پاسخدهندگان سؤال شد که آیا آنها معمولاً در یک مکان جراحی، چندین محل یکطرفه یا همه مکانها را در یک جراحی انجام میدهند یا خیر. نتایج نظرسنجی در شکل های زیر ارائه شده است. داده ها مقدماتی هستند، با توجه به اینکه تعداد پاسخ دهندگان کم بود (33) و برخی از داده های گم شده وجود دارد.
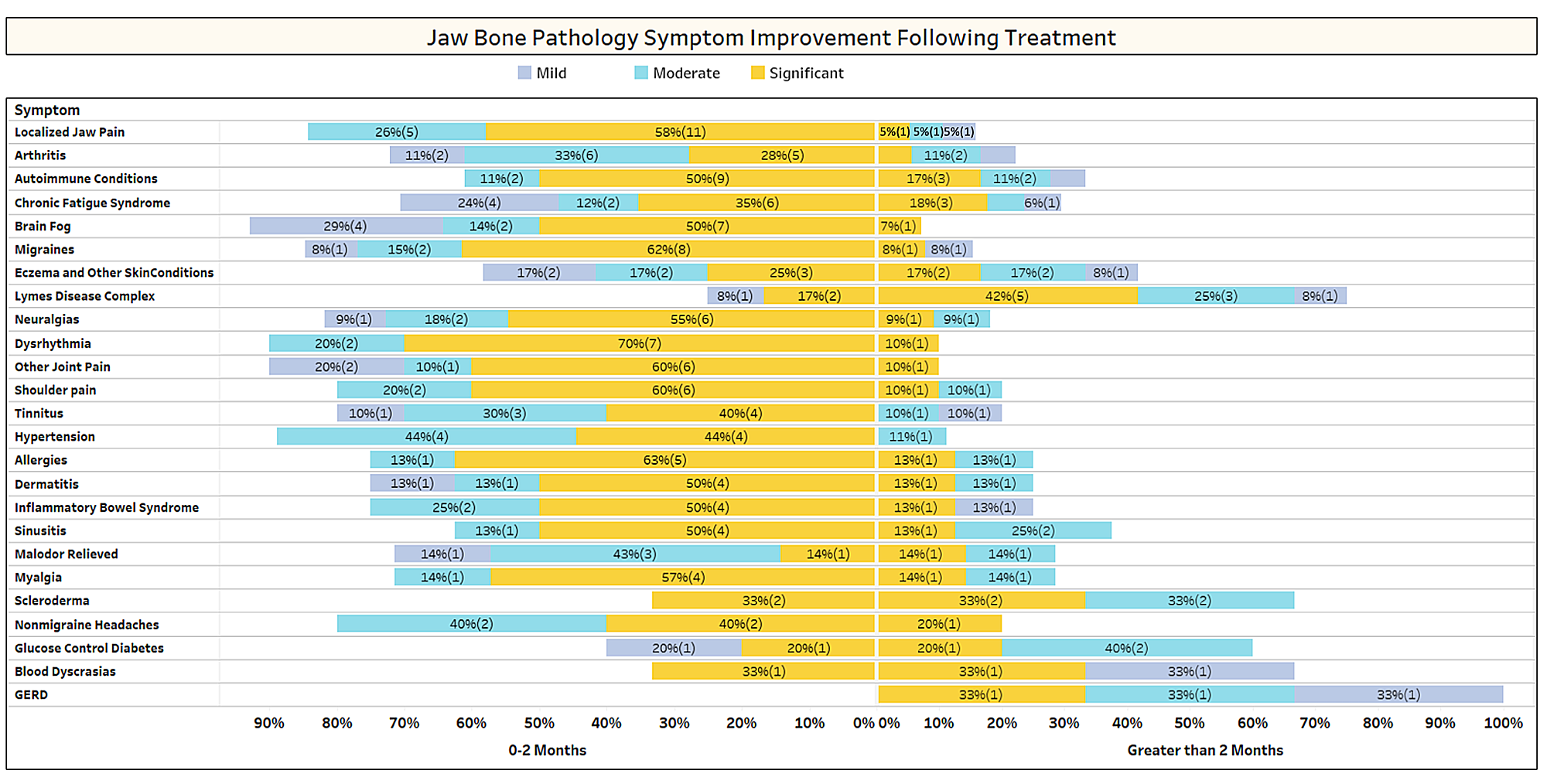
Appx I شکل 1 پاسخ دهندگان سطح بهبود را (خفیف، متوسط یا قابل توجه) ارزیابی کردند و خاطرنشان کردند که آیا بهبود به سرعت (0-2 ماه) رخ داده است یا بیشتر (بیش از 2 ماه) طول کشیده است. شرایط/علائم به ترتیب بیشترین گزارش شده فهرست شده اند. توجه داشته باشید که اکثر بیماری ها/علائم در کمتر از دو ماه بهبود می یابند (سمت چپ خط وسط).
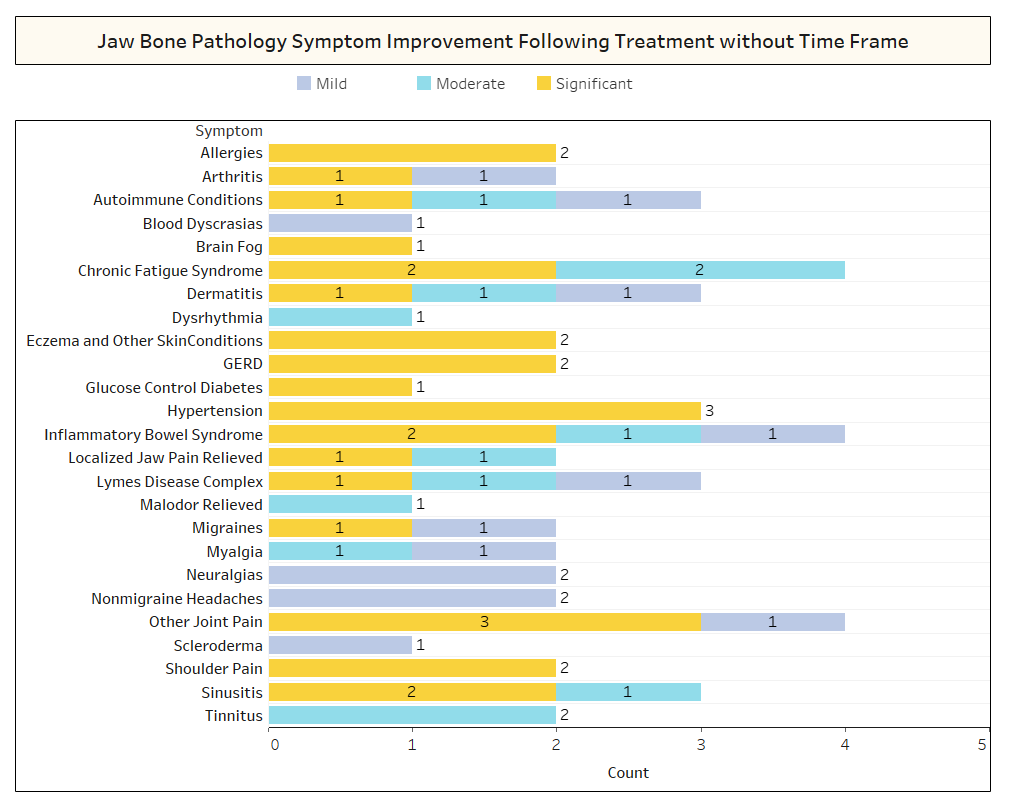
Appx I شکل 2 همانطور که در بالا نشان داده شد، در چندین مورد، پاسخ دهندگان به چارچوب زمانی بهبودی برای بهبودهایی که مشاهده شده بود توجه نکردند.
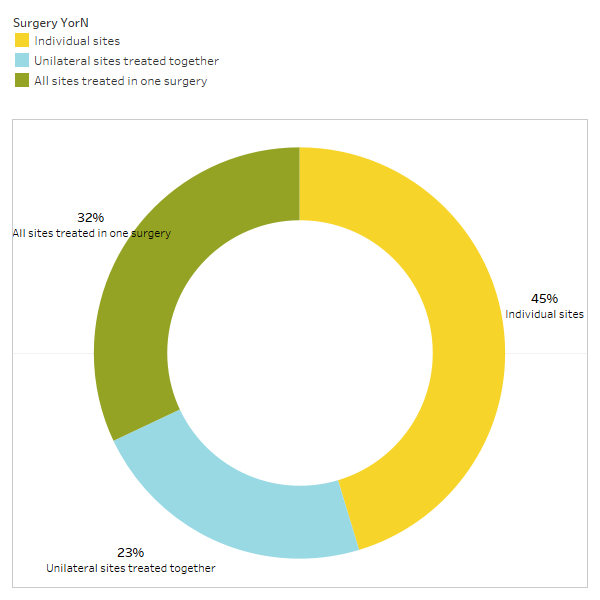
Appx I شکل 3 پاسخ دهندگان به این سؤال پاسخ دادند: «آیا معمولاً توصیه/اجرا میکنید؟
یک عمل جراحی برای نواحی منفرد، نواحی یک طرفه درمان شده با هم، یا همه محلهایی که در یک جراحی درمان شدهاند؟»
نتایج نظرسنجی IAOMT 1 (2021)
با توجه به کمبود ادبیات و بررسی موارد بالینی مربوط به درمان ضایعات حفره ای، IAOMT اعضای خود را بررسی کرد تا اطلاعاتی در مورد اینکه چه روندها و درمان هایی در حال توسعه به سمت "استاندارد مراقبت" هستند جمع آوری کند. نظرسنجی کامل در وب سایت IAOMT موجود است (توجه داشته باشید که همه پزشکان به همه سؤالات نظرسنجی پاسخ ندادند).
به طور خلاصه، اکثر 79 پاسخ دهنده درمان جراحی را ارائه می دهند که شامل انعکاس بافت نرم، دسترسی جراحی به محل کاویتاسیون، و روش های مختلف "تمیز کردن" فیزیکی و ضد عفونی کردن محل آسیب دیده است. طیف وسیعی از داروها، مواد غذایی و/یا فرآورده های خونی برای بهبود ضایعه قبل از بستن برش بافت نرم استفاده می شود.
فرزهای چرخشی اغلب برای باز کردن یا دسترسی به ضایعه استخوانی استفاده می شود. اکثر پزشکان از ابزار دستی برای کورت کردن یا خراش دادن استخوان بیمار استفاده می کنند (68%)، اما تکنیک ها و ابزارهای دیگری نیز استفاده می شود، مانند فرز چرخشی (40%)، ابزار پیزوالکتریک (التراسونیک) (35%) یا لیزر ER:YAG (36%)، که یک فرکانس لیزری است که برای پخش فوتوآکوستیک استفاده می شود.
هنگامی که سایت تمیز، دبرید، و/یا کورت شد، اکثر پاسخ دهندگان از آب/گاز اوزون برای ضدعفونی و ارتقای بهبودی استفاده می کنند. 86 درصد از پاسخ دهندگان از PRF (فیبرین غنی از پلاکت)، PRP (پلاسمای غنی از پلاکت) یا PRF ازن دار یا PRP استفاده می کنند. یک تکنیک ضد عفونی امیدوارکننده گزارش شده در ادبیات و در این بررسی (42٪) استفاده حین عمل از Er:YAG است. 32 درصد از پاسخ دهندگان از هیچ نوع پیوند استخوانی برای پر کردن محل کاویتاسیون استفاده نمی کنند.
اکثر پاسخ دهندگان (59٪) معمولاً ضایعات را بیوپسی نمی کنند و دلایل مختلفی از جمله هزینه، ناتوانی در به دست آوردن نمونه های بافت زنده، مشکل در یافتن آزمایشگاه آسیب شناسی یا اطمینان از وضعیت بیماری را بیان می کنند.
اکثر پاسخ دهندگان قبل از عمل (79%)، در حین جراحی (95%) یا بعد از عمل (69%) از آنتی بیوتیک استفاده نمی کنند. سایر حمایت های IV که استفاده می شود شامل استروئیدهای دگزامتازون (8٪) و ویتامین C (48٪) است. بسیاری از پاسخ دهندگان (52٪) از لیزر درمانی سطح پایین (LLLT) پس از عمل برای اهداف درمانی استفاده می کنند. بسیاری از پاسخ دهندگان حمایت از مواد مغذی از جمله ویتامین ها، مواد معدنی و داروهای هومیوپاتی مختلف را قبل از (81٪) و در طول (93٪) دوره بهبودی توصیه می کنند.
 تصاویر
تصاویر
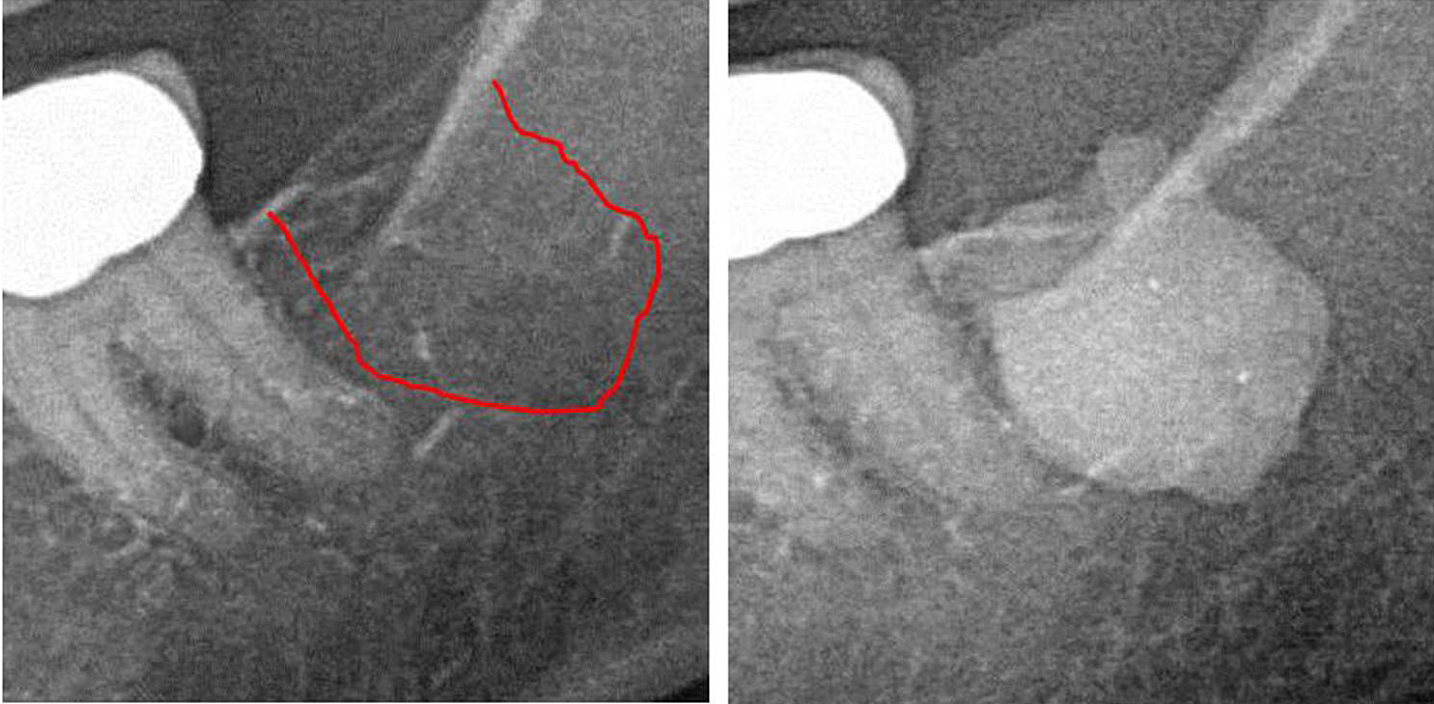
Appx III شکل 1 پانل سمت چپ: تشخیص 2 بعدی اشعه ایکس ناحیه 38. پانل سمت راست: مستندسازی وسعت FDO) در ناحیه رترومولار 38/39 با استفاده از ماده حاجب پس از جراحی FDOJ.
اختصارات: FDOJ، استئونکروز دژنراتیو چربی استخوان فک.
اقتباس از Lechner، و همکاران، 2021. "کاویتاسیون استخوان فک بیان شده RANTES/CCL5: مطالعات موردی مرتبط با التهاب خاموش در استخوان فک با معرفت شناسی سرطان پستان." سرطان سینه: اهداف و درمان
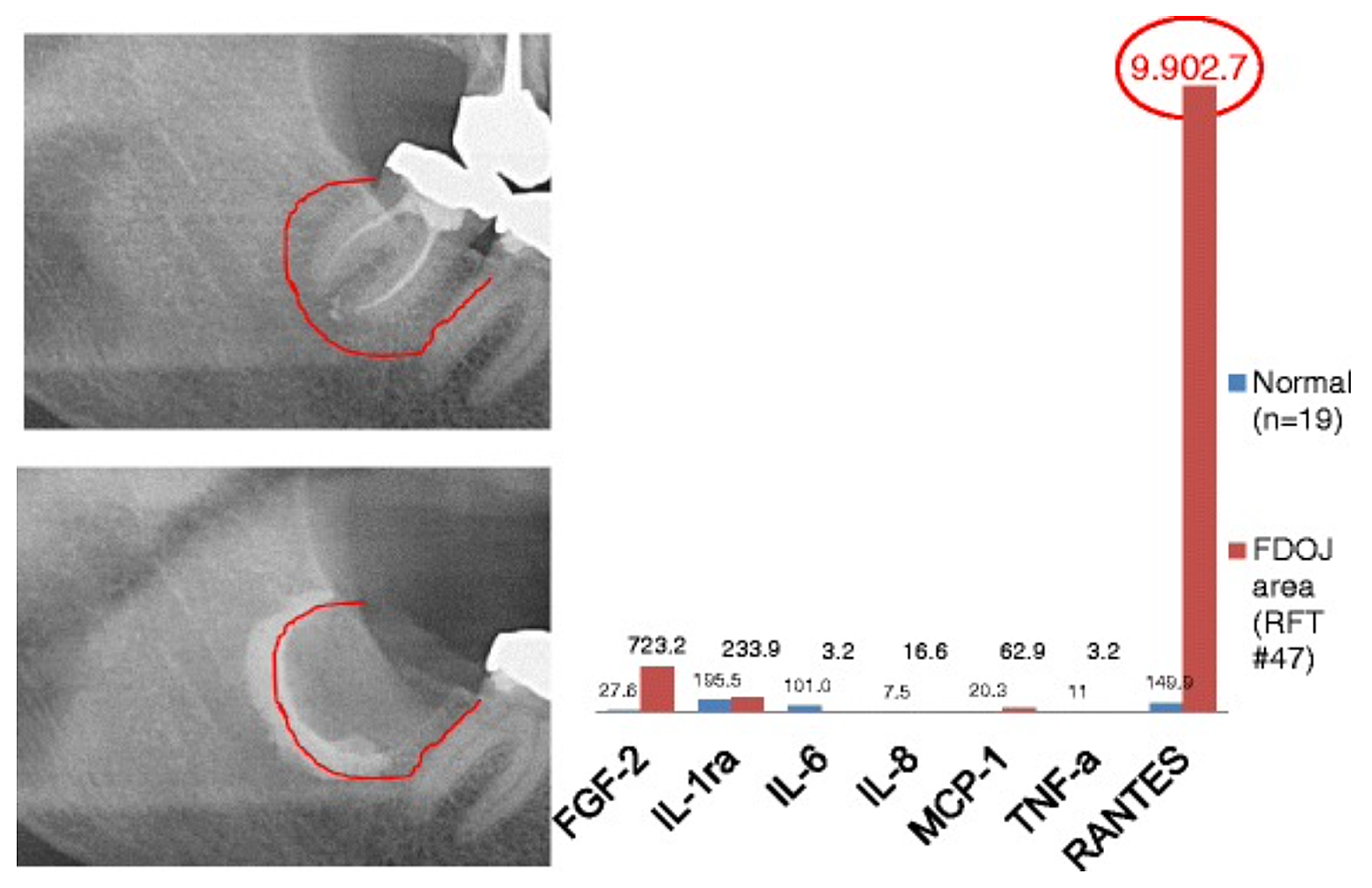
Appx 3 شکل 2 مقایسه هفت سیتوکین (FGF-2، IL-1ra، IL-6، IL-8، MCP-1، TNF-a و RANTES) در FDOJ زیر RFT #47 با سیتوکینهای موجود در استخوان فک سالم.n = 19). مستندات حین عمل اکستنشن FDOJ در استخوان فک پایین سمت راست، ناحیه 47 اپیکال RFT #47، توسط ماده حاجب پس از برداشتن RFT #47 با جراحی.
اختصارات: FDOJ، استئونکروز دژنراتیو چربی استخوان فک.
اقتباس از Lechner and von Baehr، 2015. "Chemokine RANTES/CCL5 به عنوان پیوند ناشناخته بین بهبود زخم در استخوان فک و بیماری سیستمیک: آیا پیش بینی و درمان های متناسب در افق است؟" مجله EPMA
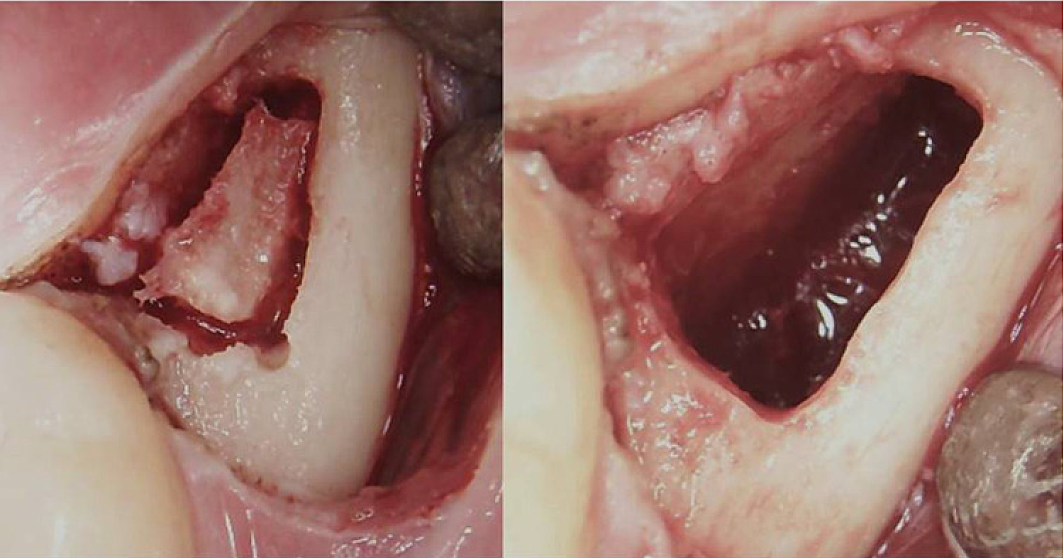
Appx III شکل 3 روش جراحی برای BMDJ/FDOJ رترومولار. پانل سمت چپ: پس از تا کردن فلپ موکوپریوستئال، یک پنجره استخوانی در قشر ایجاد شد. پانل سمت راست: حفره مدولاری کورت شده.
اختصارات: BMDJ، نقص مغز استخوان در استخوان فک. FDOJ، استئونکروز دژنراتیو چربی استخوان فک.
اقتباس از Lechner، و همکاران، 2021. "سندرم خستگی مزمن و نقایص مغز استخوان فک - گزارش موردی در مورد تشخیص اضافی دندان با اشعه ایکس با سونوگرافی." مجله گزارش های مورد پزشکی بین المللی
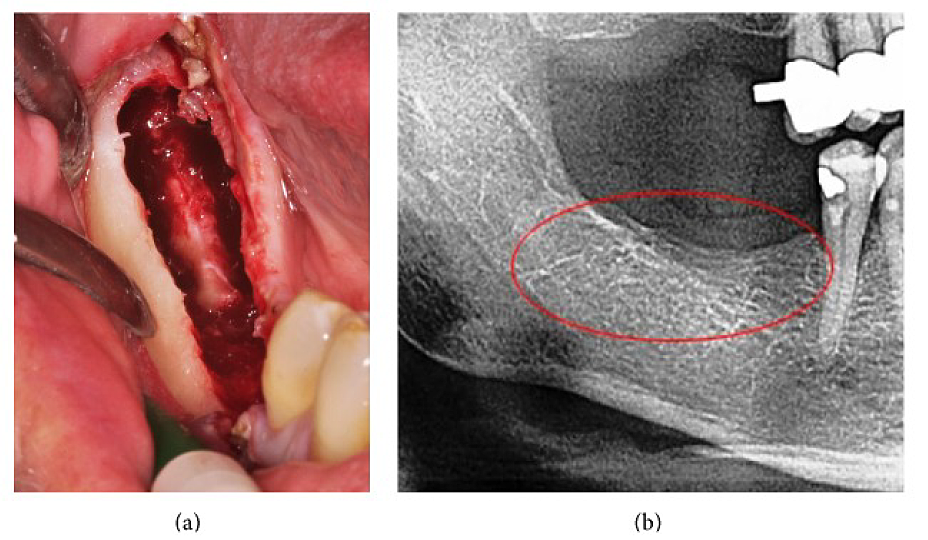
Appx III شکل 4 (الف) کورتاژ FDOJ در فک پایین با عصب فرو آلوئولار برهنه شده. ب) اشعه ایکس متناظر بدون هیچ نشانه ای از فرآیند پاتولوژیک در استخوان فک.
اختصارات: FDOJ، استئونکروز دژنراتیو چربی استخوان فک
اقتباس از Lechner، و همکاران، 2015. "درد نوروپاتیک محیطی صورت/سه قلو و RANTES/CCL5 در حفره استخوان فک." پزشکی تکمیلی و جایگزین مبتنی بر شواهد
فیلم Appx III 1
کلیپ تصویری (برای مشاهده کلیپ روی تصویر دوبار کلیک کنید) از جراحی استخوان فک که گویچه های چربی و ترشحات چرکی از استخوان فک بیمار مشکوک به نکروز استخوان فک را نشان می دهد. با حسن نیت از دکتر میگل استنلی، DDS
فیلم Appx III 2
کلیپ تصویری (برای مشاهده کلیپ روی تصویر دوبار کلیک کنید) از جراحی استخوان فک که گویچه های چربی و ترشحات چرکی از استخوان فک بیمار مشکوک به نکروز استخوان فک را نشان می دهد. با حسن نیت از دکتر میگل استنلی، DDS
برای دانلود یا چاپ این صفحه به زبانی دیگر، ابتدا زبان خود را از منوی کشویی در بالا سمت چپ انتخاب کنید.
مقاله موقعیت IAOMT در مورد نویسندگان حفره های استخوان فک انسان













